2021年5月25日,韩国全南大学/韩国医学微机器人研究所的科研人员在ACS Nano上发表“Primary Macrophage-Based Microrobots: An Effective Tumor Therapy In Vivo by Dual-Targeting Function and Near-Infrared-Triggered Drug Release”,提出了一种使用微型机器人进行有效抗癌治疗的策略。
巨噬细胞 (MΦ) 能够感知趋化性线索并定位肿瘤,因此提供了一种很好的方法来设计这些细胞以提供治疗药物来治疗疾病。然而,目前基于细胞的药物递送系统通常使用商业细胞系,当注射到宿主动物中时,这些细胞系可能会引发免疫反应。此外,过早的脱靶药物释放也仍然是一个巨大的挑战。在这里,科研人员从 BALB/c 小鼠的脾脏中分离和区分了 MΦ,并开发了基于双靶向 MΦ 的微型机器人,受趋化性和外部磁场调节,并在肿瘤部位具有精确的时空受控药物释放以响应近红外激光照射。这些微型机器人是通过将柠檬酸 (CA) 包覆的超顺磁性纳米粒子 (MNP) 和含有多柔比星 (DOX) 的热敏纳米脂质体 (TSLP) 共载到 MΦ 中来制备的。CA-MNPs 促进了微型机器人的磁性靶向功能,并且还允许响应 NIR 辐射进行光热加热,从而触发 TSLPs 的药物释放。体外实验表明,微型机器人有效地浸润了 3D 乳腺癌肿瘤球体中的肿瘤,尤其是在磁场存在的情况下,并有效地诱导肿瘤细胞死亡,近红外激光照射进一步增强。体内实验证实,磁场和近红外激光的应用可以在亚治疗剂量的 DOX 和单次注射微型机器人的情况下显着抑制肿瘤的生长。
该研究提出了一种使用开发的微型机器人进行有效抗癌治疗的策略。
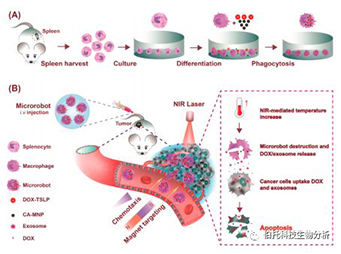
基于 MΦ 的微型机器人的抗癌疗法的工作原理示意图
(A) 微型机器人是脾细胞衍生的 MΦ,装有 CA-MNP 和 DOX-TSLP。
(B) 微型机器人被肿瘤细胞释放的电磁场和化学梯度吸引到肿瘤部位。然后通过 NIR 介导的药物释放破坏靶向肿瘤细胞。
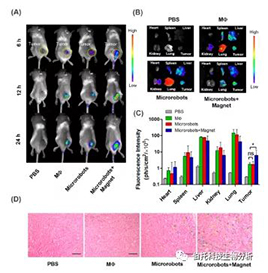
微型机器人肿瘤靶向的体内表征
(A) PBS、MΦ、微型机器人或微型机器人 + 磁铁在 6、12 和 24 小时时间点的 4T1 荷瘤小鼠的荧光图像。
(B, C) 小鼠器官的离体荧光图像,具有颜色编码的平均荧光强度。
(D) 来自如 (A) 中所述处理的小鼠的肿瘤的普鲁士蓝染色;比例尺 = 50 μm。
*:本文献中使用了德国伯托的小动物活体影像系统Berthold NightOWL LB983。
文章链接:
DOI: 10.1021/acsnano.1c00114
